医用口罩出口美国的FDA注册方法和步骤
在讲述如何注册FDA之前,先告诉大家一个官方链接,就是去验证FDA是否真实:https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfRL/rl.cfm
各位在注册FDA之前,最好去官网上看一下原文如何操作。官方网址是:https://www.fda.gov/medical-devices/how-study-and-market-your-device/device-registration-and-listing
在美国生产和销售医疗器械的营业场所(也称为机构或设施)的所有者或经营者必须每年向美国食品和药物管理局FDA注册。这一过程被称为机构注册(美国联邦法规第21篇第807部分)。
国会已经授权食品和药物管理局FDA对生产设备的机构收取年度机构注册费。需要注册和支付费用的设备机构类型的详细列表可在“谁必须注册、列出和支付费用”中找到。机构注册费不符合降低小企业费的条件。
2020年度注册用户费用为5,236美元
大多数需要在食品和药物管理局FDA注册的机构还需要列出在那里生产的设备以及在这些设备上进行的活动。如果设备在美国上市前需要上市前批准或通知,则所有者/运营商还应提供美国食品和药物管理局FDA上市前提交编号(510(k),PMA,PDP,HDE,De Novo)。
注册和列表登记为食品和药物管理局FDA提供了医疗器械机构的位置以及在这些机构生产的器械的详细信息。对于这些设备是在哪里制造的提高了国家对突发公共卫生事件的准备和反应能力。
有关注册和上市状态的帮助,请联系注册和上市办公室:
电话:301-796-7400 ,电子邮件:reglist@cdrh.fda.gov
如需有关政策或拘留问题的帮助,请联系注册和上市工作人员:
电话:301-796-7400, 电子邮件:device.reg@fda.hhs.gov
上述信息为FDA官方给予的注册要求,具体的FDA证书申请的方法和步骤如下:
FDA医用口罩分为两类:无菌、非无菌
1、DUNS码及FDA账号申请(2周时间)
2、如果申请小企业审核费用减免,下载Form3602A到税务机关填写盖章后邮寄至FDA,60天内答复。
3、审核费用缴纳。
4、510k文件准备
5、通过产品的code,regulation number等对产品所适用的标准及法规进行解读:ISO10993,ASTM, ISO11135及FDA的系列guidance:生物相容性,无菌及性能检测。
建立性能检测报告,生物相容性评价,无菌验证文件,包装运输验证及货架期验证文件。
6、根据510k 的checklist准备510k全套文件
下载510keCopy验证软件,确认文件格式正确后提交。
510K文件通过eCopy提交至CDRH60天左右FDA回复。拿到510k证书或要求增补。
增补文件在180天内完成并eCopy提交。
如果产品销售到美国市场,一定要准备CFR820体系审核。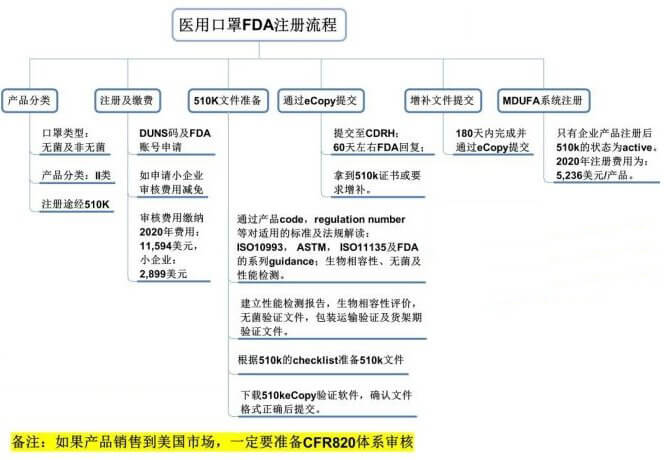
医用口罩出口欧盟的CE(MDR)注册流程:
1、无菌类:分类1S,需要公告机构介入。
2、ISO13485体系建立,已有体系证书的企业要考虑MDR的要求对体系升级。
3、建立产品的UDI系统,准备产品的技术文件
4、产品要进行生物相容性,性能检测检测;
5、建立符合MDR要求的产品技术文件,公告机构进行审核。
6、拿到CE证书,欧代在欧洲进行产品注册
非无菌类,不需要公告机构审核,企业可通过自我符合性声明途径进行产品注册,但注册前要完成:
1)要与欧盟授权代表签合同;
2)建立UDI系统用于产品注册。
3)最后要完成CE技术文档

 口罩在韩国,美国,欧盟等国家的进口要求
口罩在韩国,美国,欧盟等国家的进口要求  个人防护和医用口罩的欧盟CE认证方法及步骤
个人防护和医用口罩的欧盟CE认证方法及步骤  出口欧盟国家的防护口罩CE证书真假辨识
出口欧盟国家的防护口罩CE证书真假辨识  口罩和防疫物资出口注意事项,及各国海关认证要求
口罩和防疫物资出口注意事项,及各国海关认证要求
Leave a Reply
You must be logged in to post a comment.